15.02.2017
AMNOG 2016 – was hat das Jahr gebracht?
Wie viele Verfahren mit Start im letzten Jahr wurden bereits abgeschlossen?
Von den 2016 begonnenen Verfahren wurden 51 bis zum 15.02.2017 abgeschlossen. In der hier gezeigten Darstellung wurden auch Neubewertungen berücksichtigt. Dabei zeigt sich deutlich, dass der seit Inkrafttreten des AMNOG bestehende Trend weitergeht: Mit 24 von 51 Verfahren machten onkologische Präparate die große Mehrheit aus. Die Bandbreite der Anwendungsgebiete umfasst zwar verschiedene onkologische Erkrankungen. Schwerpunkte sind jedoch Lungenkrebs und bösartige hämatologische Erkrankungen (jeweils 8 Präparate).
Nicht überraschend sind auf Platz 2 – allerdings mit deutlichem Abstand zu den Onkologika – Arzneimittel gegen Stoffwechselerkrankungen zu finden, die meisten davon (6 von 8 Präparaten) zur Behandlung von Typ-2-Diabetes.
Bei den infektiologischen Arzneimitteln, die mit 5 Anträgen auf Platz 3 folgen, handelt es sich in erster Linie um Medikamente zur HIV-Therapie (4 von 5 Präparaten).
Zusatznutzen – ja oder nein?
Berücksichtigt man bei der Bewertung nach Subgruppen jeweils nur die höchste Klassifikation von "nicht quantifizierbar" über "gering" und "beträchtlich" bis hin zu "erheblich" und lässt die Kategorien "Beleg", "Hinweis" und "Anhaltspunkt" außen vor, zeigt sich auf den ersten Blick ein recht positives Bild. Immerhin haben mehr als die Hälfte aller Präparate mit Verfahrensstart 2016 für mindestens eine Subgruppe vom G-BA einen Zusatznutzen zugesprochen bekommen. Allerdings gingen 14 der Medikamente als "Orphan Drugs" ins Rennen und sind somit dem positiven Trend nur bedingt zuzurechnen. Ihr Zusatznutzen gilt bereits mit der Zulassung als belegt, die Bewertung des G-BA lautet in den meisten Fällen "nicht quantifizierbarer Zusatznutzen".
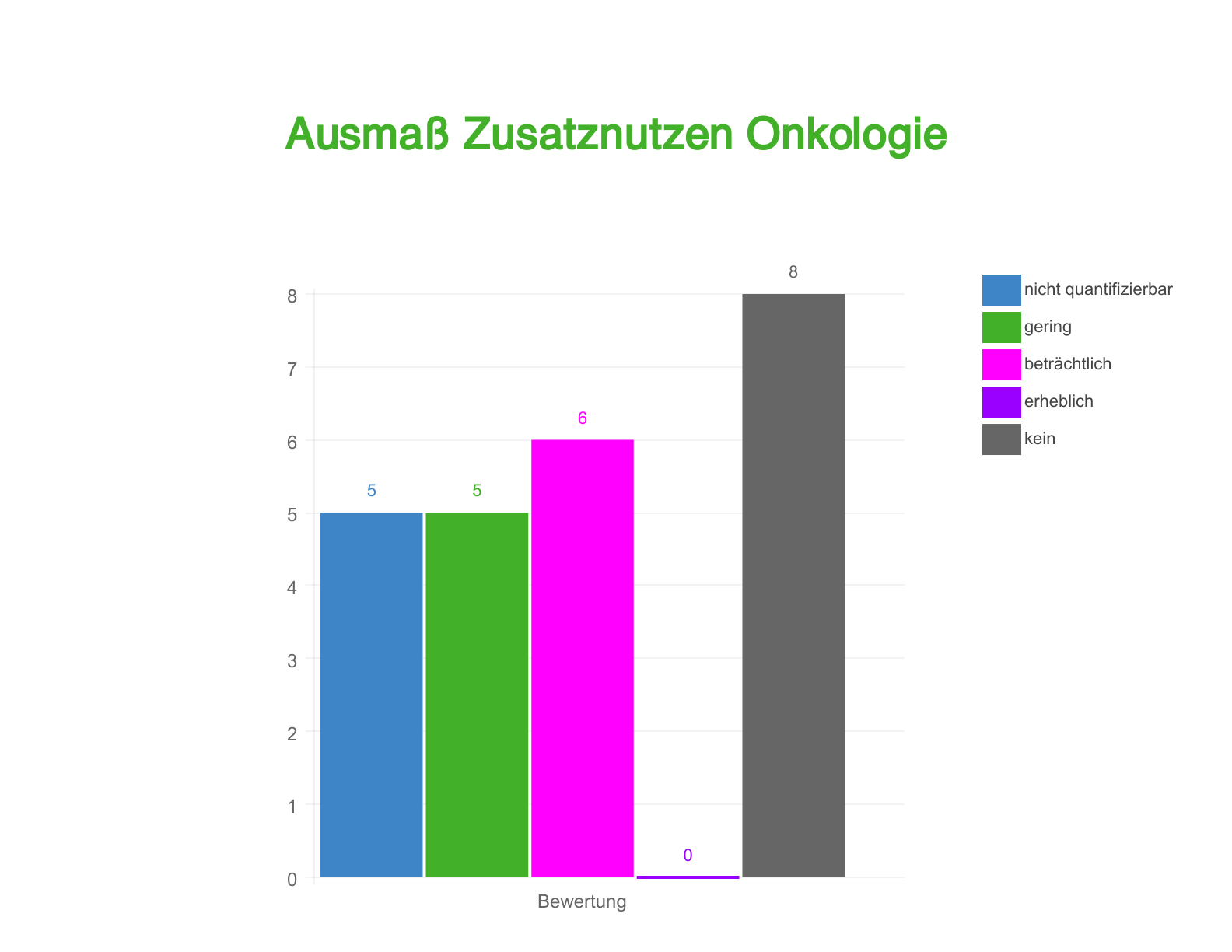
Im Bereich Onkologie sieht es bei der reinen Ja-Nein-Frage sogar noch etwas besser aus. Zwei Drittel der Medikamente (16 von 24) erhielten eine positive Nutzenbewertung für mindestens eine Patientengruppe; 6 davon werden jedoch auch offiziell als "Orphan Drugs" eingeordnet.
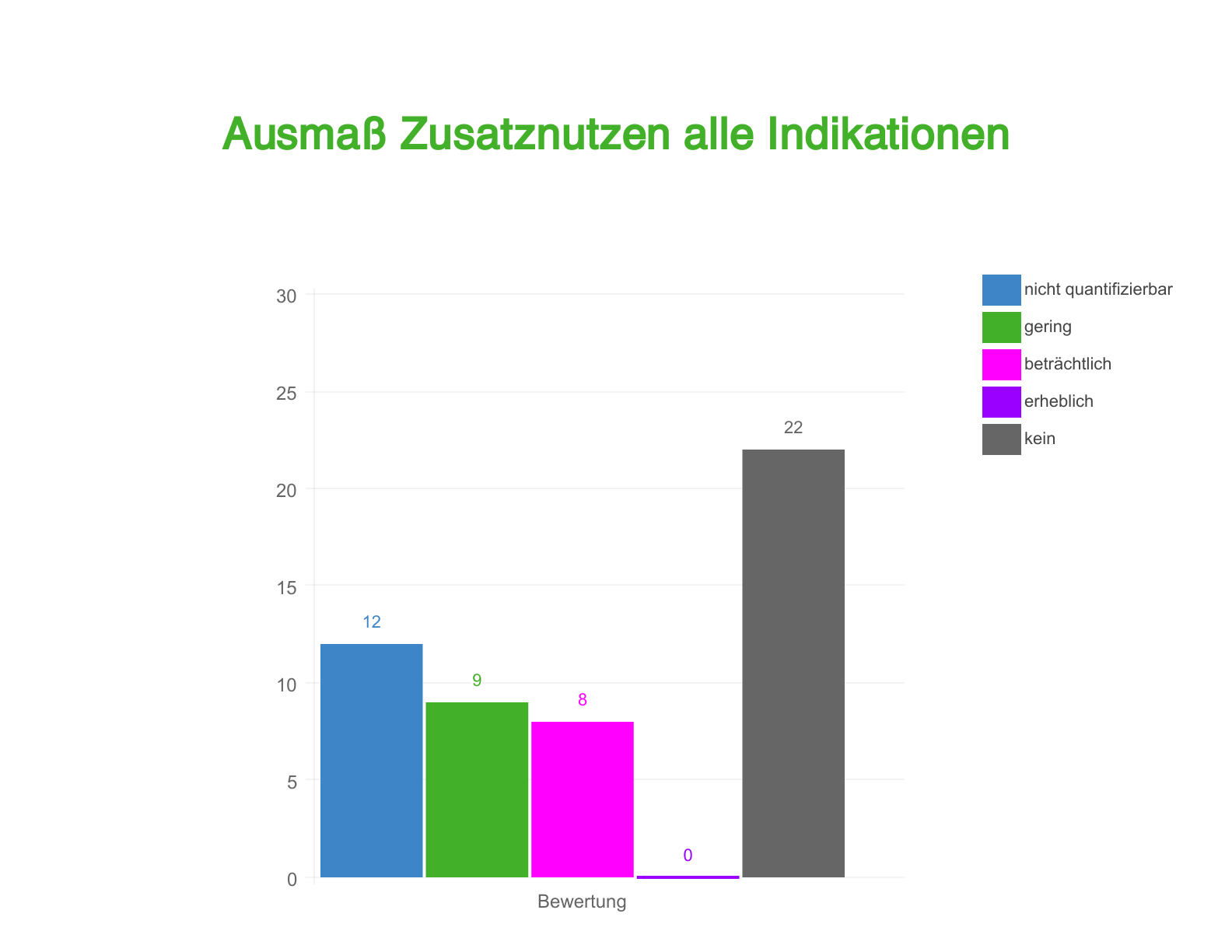
Ausmaß des Zusatznutzens in allen Indikationen und in der Onkologie
Auch bei der Darstellung des Ausmaßes wurde hier nur die jeweils höchste Subgruppen-Bewertung berücksichtigt. Dabei fällt sofort auf: Von den 5 möglichen Bewertungen vergab der G-BA "kein Zusatznutzen" insgesamt am häufigsten – und zwar sowohl bezüglich aller Indikationen als auch im onkologischen Bereich.
Während die beste Bewertung "erheblicher Zusatznutzen" bei Anträgen mit Start im Jahr 2016 bislang gar nicht vergeben wurde, lag die zweitbeste Bewertung "beträchtlicher Zusatznutzen" immerhin 8-mal vor. In 6 von 8 Fällen betraf das wiederum onkologische Präparate.
Datenquelle: https://www.g-ba.de/informationen/nutzenbewertung/
Abbildungen: © Dittmann Medical Writing 2017, eigene Darstellung